Diagnóstico molecular de la
Hemofilia
El diagnóstico molecular de la hemofilia fue
posible a partir de la clonación y caracterización de los genes FVIII y FIX. Sin
embargo, y a pesar de que la identificación de ambos genes tuvo lugar de forma
prácticamente simultánea, las peculiaridades de cada uno de ellos tales como el
tamaño, complejidad estructural, etc. han dado lugar a que las estrategias
diagnósticas hayan evolucionado de forma sensiblemente diferente.
Técnicas de diagnóstico indirecto
Se basan en estudios de ligamiento utilizando
marcadores polimórficos intra y/o extragénicos. Estos marcadores consisten en
variaciones en la secuencia del genoma de los individuos que permiten un
seguimiento del cromosoma portador del gen defectuoso. Estos marcadores
polimórficos no tienen ninguna relación con la anomalía y por tanto no
proporcionan información respecto al tipo de mutación causante de la enfermedad.
Los marcadores intragénicos son los más fiables dado que la probabilidad de
recombinación entre éstos y la mutación responsable es menor. Existen diversos
polimorfismos intragénicos descritos en el gen FVIII, dos de los cuales
consisten en repeticiones en tándem de un dinucleótido y el resto consisten en
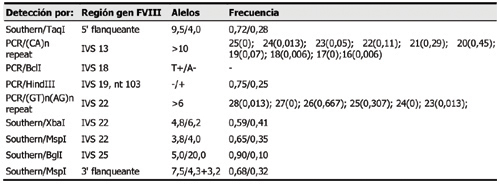
cambios que alteran dianas de restricción específicas. En la Tabla 1 se recogen
los marcadores intragénicos comúnmente utilizados en el diagnostico indirecto de
la hemofilia A.
Las repeticiones de dinucleótidos localizadas en los intrones 13 y 22 son del
tipo STR (Short Tandem Repeats) y son en la actualidad las de uso más extendido
(Dangerfield y col., 1997; Yip y col., 1994). Dado que al ser multialélicas la
heterocigosidad poblacional es superior al 50%, que es el máximo porcentaje
posible para los polimorfismos dialélicos, y proporcionan por tanto una mayor
informatividad. Aproximadamente el 75% de las mujeres de la mayoría de grupos
étnicos son heterocigotas para al menos uno de los dos polimorfismos (Goodeve,
1998). De entre las técnicas utilizadas para el estudio de estos polimorfismos
STR cabe destacar la de marcaje fluorescente y detección automática tras su
separación electroforética (Kochhan y col., 1994).
Los polimorfismos dialélicos han sido también ampliamente utilizados dado que,
si bien su grado informatividad es menor, proporcionan una mayor seguridad
diagnóstica como estudio complementario adicional. Entre éstos destacan los
polimorfismos BclI (da Silva y Figueiredo, 1994; Peake y col., 1993), HindIII y
XbaI (De Brasi y col., 1999; Goodeve, 1998).
|
|
|
Tabla 1: Polimorfismos intragénicos utilizados en el diagnóstico indirecto de la hemofilia A |
Técnicas de diagnóstico directo
El primer paso en el diagnóstico molecular directo
de la hemofilia A grave consiste en el análisis de la presencia de la inversión
del intrón 22 del gen FVIII, responsable del 40-50% de los casos. Hasta fechas
recientes la técnica empleada se basaba en el método de Southern (Southern,
1975). La digestión del DNA genómico con BclI y su posterior transferencia e
hibridación utilizando una sonda marcada correspondiente a una región del intrón
22 del gen FVIII da lugar a un patrón de bandas que permite discriminar entre
ausencia/presencia del reordenamiento (Lakich y col., 1993). La descripción de
esta técnica supuso un gran avance en el diagnóstico molecular de la hemofilia A
ya que permitió caracterizar de forma precisa el defecto genético en un elevado
porcentaje de los pacientes y posibilitó la realización de estudios fiables
tanto de mujeres portadoras como de diagnóstico prenatal (Antonarakis y col.,
1995).
Recientemente ha sido descrita una nueva técnica basada en la amplificación
simultánea mediante PCR de fragmentos genómicos de gran tamaño correspondientes
a la región del intrón 22 del gen FVIII conteniendo el gen F8A y a sus dos
copias teloméricas homólogas (Liu y col., 1998; Liu y Sommer, 1998). Tal y como
se ilustra en la Figura 6 (Pág. 31), esta técnica utiliza dos pares de
oligonucleótidos (AB y PQ) que delimitan las regiones homólogas donde tiene
lugar la recombinación. Amplímeros cuyo tamaño varía entre las 10 y las 12 Kb
son separados electroforéticamente y el patrón de bandas resultantes permite
discriminar entre varones afectos, mujeres portadoras e individuos negativos
para la inversión.
Una vez descartada la presencia de la inversión del intrón 22, el estudio de las
mutaciones en el gen FVIII se lleva a cabo mediante diversas técnicas, que
pueden ser enmarcadas en dos bloques estratégicos:
i) Técnicas de screening de mutaciones: su finalidad es la de analizar regiones
o segmentos amplificados del gen de forma que alguna característica
físico-química permita diferenciar entre un fragmento control y su homólogo
conteniendo una alteración puntual. Se han descrito diferentes técnicas de
screening para el diagnóstico molecular de la hemofilia. Todas ellas tienen la
peculiaridad común de que tras analizar los diferentes fragmentos y determinar
los sospechosos de ser portadores de una mutación éstos deben ser secuenciados
para corroborar la existencia de la alteración y si ésta puede ser responsable
de la enfermedad. De entre las descritas cabe destacar las siguientes:
Single Strand Conformational Polymorphism (SSCP). Se basa en la migración
electroforética diferencial de las secuencias de DNA de cadena sencilla en las
cuales, mutaciones puntuales alteran su estructura secundaria (Orita y col.,
1989). Al ser una de las primeras técnicas descritas, numerosos grupos la han
empleado para el diagnóstico molecular de la hemofilia A con resultados diversos
en términos de eficiencia y sensibilidad (Akkarapatumwong y col., 2000; Economou
y col., 1992; Lin y col., 1993; Pieneman y col., 1995; Strmecki y col., 1999).
Denaturing Gradient Gel Electrophoresis (DGGE). Los fragmentos de DNA son
separados en geles desnaturalizantes en gradiente de urea/formamida. Las
variaciones entre secuencias homólogas producen diferencias en su temperatura de
fusión y cambios de movilidad en este tipo de geles (Fischer y Lerman, 1980;
Fischer y Lerman, 1983). Si bien ha sido empleada por diversos grupos de
investigación para la determinación de las alteraciones del gen FVIII (Chan y
col., 1996; Higuchi y col., 1991; Higuchi y col., 1991; Lavergne y col., 1992;
Schwaab y col., 1995; Traystman y col., 1990), en la actualidad no es una
técnica ampliamente utilizada.
Conformational Sensitive Gel Electrophoresis (CSGE). Esta técnica, desarrollada
por Ganguly y colaboradores (Ganguly y col., 1993), se basa en la detección de
moléculas heterodúplex formadas por la hibridación entre un DNA control y su
homologo portador de una mutación. Estas moléculas presentan una movilidad
electroforética aberrante que permite diferenciarlas en geles desnaturalizantes
(Williams y col., 1998).
Amplification and Mismatch Detection (AMD). Las moléculas heterodúplex formadas
por la hibridación entre un DNA control y su homólogo portador de la mutación
presentan posición/es de no apareamiento que pueden ser modificadas químicamente
y posteriormente cortadas por tratamiento con piperidina. Su posterior
electroforesis en geles desnaturalizantes permite establecer el lugar aproximado
del corte y por tanto localizar la mutación (Cotton y col., 1988). Ha sido
utilizada con relativo éxito por algunos laboratorios (Naylor y col., 1992;
Waseem y col., 1999).
Denaturing High Performance Liquid Chromatography (dHPLC). Es la técnica de
screening de aparición más reciente (Oefner y Underhill, 1995). Las moléculas
heterodúplex presentan tiempos de retención diferentes de los de sus homólogas
homodúplex cuando son sometidas a cromatografía líquida en fase reversa en
gradiente continuo de acetonitrilo. Este comportamiento permite identificar el
fragmento amplificado portador potencial de la alteración para su posterior
análisis. Esta técnica ha sido evaluada recientemente por un único grupo para
detectar las mutaciones en un total de 183 pacientes afectos de hemofilia A
(Oldenburg y col., 2001).
ii) Secuenciación directa: esta aproximación es la más simple conceptualmente ya
que consiste en el análisis directo del gen FVIII mediante la determinación de
la secuencia de nucleótidos de las regiones consideradas como relevantes. Éstas
incluyen los exones, las zonas intrónicas flanqueantes y las regiones implicadas
en la regulación de la expresión. Sin embargo, el enorme tamaño del gen FVIII ha
disuadido a los diversos laboratorios implicados en el diagnóstico molecular de
la hemofilia A de recurrir a la secuenciación sistemática del gen. Por otra
parte, ésta ha sido llevada a cabo siguiendo protocolos muy laboriosos que son
difícilmente aplicables a la rutina de manera generalizada (Paynton y col.,
1991). Ello ha dado lugar a que, hasta fechas muy recientes, el uso de
protocolos de secuenciación nucleotídica directa se haya restringido al estudio
de mutaciones en aquellos casos en los que otras técnicas no han posibilitado su
identificación (Higuchi y col., 1990) o en combinación con otras estrategias
tales como las técnicas de screening o de RT-PCR a partir de mRNA ectópico
(Bidichandani y col., 1995; Tavassoli y col., 1997).
Técnicas de diagnóstico
indirecto
Hasta fechas recientes las técnicas de diagnóstico indirecto han sido ampliamente utilizadas en los estudios moleculares de la hemofilia B (Toyozumi y col., 1995; Winship y col., 1993; Winship y col., 1989) a pesar de que la región codificante del gen FIX, a diferencia de la del gen FVIII, no es muy extensa. Se han empleado la mayoría de los doce polimorfismos descritos en el gen FIX en los estudios de ligamiento, siete de los cuales se muestran en la Tabla 2. Once corresponden a variaciones dialélicas y uno de ellos es multialélico (Figueiredo y col., 1994; Peake y col., 1993), pudiendo ser todos ellos detectados mediante la técnica de PCR-RFLP.
A diferencia del gen FVIII, existe una marcada
variación étnica respecto al grado de heterocigosidad de los polimorfismos del
gen FIX, por lo que la elección de los mismos ha de estar condicionada por el
origen racial (Goodeve, 1998).
|
|
|
Tabla 2: Polimorfismos utilizados en el diagnóstico indirecto de la hemofilia B. |
Técnicas de diagnóstico directo
i) Técnicas de screening de mutaciones: el mismo
tipo de técnicas utilizadas en hemofilia A han sido también empleadas para
identificar la mutación en el gen FIX. De forma resumida cabe destacar las
siguientes: SSCP (David y col., 1998; David y col., 1993; Mitchell y col.,
1999). Mediante esta técnica Montejo y colaboradores identificaron la mutación
en un total 76 pacientes, 21 de los cuales presentaban mutaciones no descritas
previamente (Montejo y col., 1999). La técnica de DGGE ha sido empleada por dos
grupos (Attali y col., 1999; Tartary y col., 1993), permitiendo en el de Attali
y colaboradores elucidar la mutación en 68 pacientes. Por último, las técnicas
de CSGE (Hinks y col., 1999; Tagariello y col., 2000) y de AMD (Montandon y
col., 1989; Rowley y col., 1995) también han sido muy útiles en el diagnóstico
molecular de la hemofilia B.
ii) Secuenciación directa: la menor complejidad del gen FIX respecto de la del
gen FVIII ha propiciado que diversos laboratorios hayan optado por analizar
directamente la mutación mediante la secuenciación exhaustiva de todas las
regiones génicas relevantes. De forma general la estrategia utilizada es la
secuenciación directa mediante la técnica de dideoxinucleótidos marcados con
fluorocromos específicos para cada una de las bases. Weinman y colaboradores
determinan la mutación en 26 casos (Weinmann y col., 1998) mientras que el grupo
de Costa ha desarrollado más recientemente un protocolo que combina una PCR
múltiple de nueve fragmentos que incluyen los ocho exones del gen FIX y su
región promotora con la secuenciación cíclica usando terminadores fluorescentes
(Costa y col., 2000).
Diagnóstico de mujeres
portadoras
Es vital para las mujeres pertenecientes a familias
con historial de hemofilia saber si son portadoras o no de la enfermedad, dado
que de ello depende la posibilidad de transmitirla a su progenie. El primer paso
para conocer su condición de portadoras consiste en la realización de un árbol
genealógico de la familia con información clínica fiable de los varones
afectados. Dado que su herencia está ligada al cromosoma X es posible
diferenciar en una primera instancia entre portadoras obligadas y posibles
portadoras. En las primeras, la probabilidad de que uno de sus dos cromosomas X
contenga el gen afectado es prácticamente del 100%. Es el caso, por ejemplo, de
hijas de padres hemofílicos o de madres de más de un hijo afecto. El estado de
posible portadora se da en diversos casos como el de mujeres con familiares
hemofílicos por línea materna, hermanas de hemofílicos o mujeres con un hijo
hemofílico sin que existan antecedentes familiares. En cambio, una mujer no
puede ser portadora si, procediendo de una familia con hemofílicos por vía
paterna, su padre no padece la enfermedad.
Existen dos tipos de estudios para la determinación del estado de portadora: el
estudio fenotípico y el estudio del DNA o genotípico.
Las portadoras de hemofilia presentan un nivel de
actividad de FVIII o FIX que como promedio oscila entre el 50% y el 75% con
respecto del normal, generalmente suficiente para una hemostasia no patológica.
Dichos porcentajes son tan solo una referencia aproximada dado que se ha
observado que las mujeres portadoras muestran un patrón de variabilidad superior
al de mujeres no portadoras (Veltkamp y col., 1968). Dicha gran variabilidad en
mujeres portadoras de hemofilia A o B se atribuía al fenómeno de inactivación al
azar de uno de los dos cromosomas X que tiene lugar en las primeras fases del
desarrollo embrionario. Estudios recientes parecen descartar dicho fenómeno
según se desprende de la falta de correlación entre inactivación y
concentraciones de factor en plasma (Orstavik y col., 2000). Esta situación,
unida a la inherente variabilidad de los niveles en la población normal, da
lugar a un notable solapamiento entre ambos grupos de valores que hace difícil
establecer la condición de portadora en función de datos fenotípicos. Además,
las concentraciones de los factores coagulantes pueden modificarse en diversos
estados inflamatorios, enfermedades hepáticas o de otro tipo y tras la
administración de determinados medicamentos. Sólo cuando una mujer posible
portadora presenta niveles de actividad claramente por debajo de los valores
normales se puede asumir de forma razonable que es portadora del gen afectado.
A pesar de las mencionadas limitaciones, y cuando no es posible recurrir al
estudio del DNA, el estudio de portadoras de hemofilia A se puede abordar
mediante el análisis de dos variantes: el nivel de actividad procoagulante del
FVIII (FVIII:C) y los niveles de antígeno FvW circulante. Cuando el cociente
entre ambos valores es inferior a 0,5 la probabilidad de que la mujer sea
portadora es elevada. Hay que tener en cuenta en este tipo de análisis diversos
parámetros como la edad y el grupo sanguíneo, dado que las mujeres de grupo A, B
o AB presentan unos niveles más altos que además cambian con los años (Orstavik
y col., 1989; Orstavik y col., 1985). En el caso del estudio de portadoras de
hemofilia B se utiliza el FIX:C teniendo en cuenta además otros parámetros como
la toma de anticonceptivos orales. El nivel de antígeno FIX puede ser de
utilidad en algunos casos pero no está justificado determinarlo de forma
sistemática.
Dado que la presencia de niveles normales de actividad coagulante no excluyen el
estado de portadora, y de que ni tan sólo niveles alterados lo confirman en
muchos de los casos, la detección de portadoras mediante el estudio fenotípico
suele ser difícil, algunas veces orientativa y en pocas ocasiones definitiva.
Cocientes FVIII:C/ FvWAg anormalmente bajos se han encontrado en personas
normales, así como falsos diagnósticos positivos y negativos. Tras la aparición
de técnicas que permiten el análisis del DNA, los estudios fenotípicos han
quedado en segundo plano, utilizándose como ayuda en aquellos casos en que el
estudio de DNA no es posible o no es informativo.
El estudio genotípico se puede abordar mediante técnicas de diagnóstico
indirecto o directo, tal y como ya se ha descrito en apartados anteriores. Los
procedimientos de diagnóstico indirecto basados en el análisis del ligamiento a
partir de marcadores intra o extragénicos han sido fundamentales para poder
desarrollar con eficacia el análisis de mujeres posible portadoras. Muchas de
las familias que lo han solicitado han podido así disponer de un adecuado
consejo genético. Sin embargo existen toda una serie de limitaciones inherentes
a estos procedimientos entre las que cabe destacar la imposibilidad de obtener
muestras de parientes clave para el estudio, los casos esporádicos en los cuales
la ausencia de historial familiar para la enfermedad no permite determinar el
cromosoma afecto con garantías, la posibilidad de que tenga lugar una
recombinación entre el marcador utilizado y el gen afecto y la falta de
informatividad de los marcadores utilizados (Goodeve, 1998).
La incorporación de técnicas de diagnóstico molecular destinadas a caracterizar
la mutación en cada paciente soluciona muchas de las limitaciones anteriormente
mencionadas. Una vez encontrado el defecto genético en el paciente no es
necesario volver a analizar todo el gen en la mujer o mujeres con riesgo de ser
portadoras ya que la amplificación por PCR del fragmento génico implicado y su
posterior secuenciación son suficientes para asegurar el resultado con casi
total garantía. Una excepción a dicha afirmación la encontramos en los casos de
mutaciones causadas por mosaicismo germinal. En estas circunstancias una mujer
cuando se trata de mujeres emparentadas con pacientes hemofílicos esporádicos.
Así, la ausencia de mutación en el genoma de determinadas células somáticas (los
linfocitos suelen ser la muestra habitual de análisis) de una mujer que ha
tenido un hijo hemofílico sin antecedentes familiares para la enfermedad no
descarta que parte de su línea germinal sea portadora del cromosoma afecto.
Cuando se da una verdadera mutación de novo en el hijo, entonces se trataría de
un mosaicismo somático que no podría tener consecuencias sobre sus futuros
hermanos. La presencia de mosaicismos germinales y somáticos se ha comprobado en
ambos tipos de hemofilia si bien su importancia como origen de la patología esta
posiblemente infravalorada. Ello es debido a limitaciones de sensibilidad ya
que, salvo contadas excepciones, los métodos habitualmente utilizados aseguran
eficacia en la detección de aquellos casos de mosaicismo en que la mutación se
encuentra en al menos el 5% del DNA total (Saad y col., 1994).
Hasta el principio de la década de los setenta, la recomendación habitual para
muchas de las mujeres que eran portadoras obligadas, o incluso posibles
portadoras, era la de abstenerse de tener descendencia. Un avance supuso, en
aquellas familias que deseaban un estudio prenatal, la determinación del sexo en
el feto mediante amniocentesis en la semana 15-16 de gestación. Sin embargo ello
suponía que un 50% de los fetos varones sufrían interrupción del embarazo a
pesar de ser sanos (Tedgard, 1998).
Desde 1979 ha sido posible identificar a los fetos afectos de hemofilia en
familias de riesgo mediante la toma de pequeñas cantidades de sangre obtenidas
directamente por punción de la vena umbilical a las 18-22 semanas de gestación,
gracias a las técnicas de seguimiento ecográfico y a la determinación de la
actividad coagulante del FVIII o FIX (Mibashan y col., 1979). Dos importantes
limitaciones de esta técnica, denominada funiculocentesis, son su elevado riesgo
de aborto (2%) y la avanzada fase de gestación en la que se realiza. Esto
conlleva a menudo secuelas psicosomáticas serias en caso de producirse
finalmente la interrupción del embarazo, ya sea por causas técnicas o
diagnósticas (Tedgard y col., 1989).
Todos estos métodos han sido superados por la aplicación de las técnicas de
diagnóstico molecular directamente sobre el DNA fetal. Existen dos tipos de
procedimientos para la obtención de la muestra fetal y ambos se basan, al igual
que la funiculocentesis, en técnicas invasivas si bien el riesgo de aborto que
conlleva su práctica es inferior. El método más ampliamente utilizado
actualmente para el diagnostico molecular prenatal es la biopsia de corion, la
cual contiene una muestra de vellosidades coriales cuyo genoma es idéntico al
fetal. Un segundo método no tan extendido es la amniocentesis u obtención del
líquido amniótico. Ambos métodos tienen sus ventajas e inconvenientes. Así, la
biopsia corial se puede realizar a partir de las 10-11 primeras semanas de
gestación mientras que la extracción de líquido amniótico se efectúa a partir de
la semana 14, lo cual supone un retraso diagnóstico a considerar en términos
médicos y sociales. Sin embargo la biopsia corial requiere un análisis
morfológico adicional para confirmar que el material extraído es de origen fetal
y no materno, posibilidad que es preciso descartar completamente para evitar
posibles errores diagnósticos. Por otra parte el riesgo de aborto en este último
caso es ligeramente superior al de la amniocentesis.
Una alternativa a dichos métodos consiste en la obtención de líquido amniótico
en estadíos tempranos de la gestación mediante el procedimiento denominado
amniofiltración. Esta técnica consiste en la obtención, mediante microfiltración
en circuito cerrado, de la fracción celular y el retorno del líquido amniótico
sobrante al saco embrionario (Sundberg y col., 1993). De esta forma se pueden
obtener cantidades suficientes de material fetal a las 11 semanas de gestación,
fase temprana comparable a la de las vellosidades coriales, pero con un riesgo
de aborto inferior y una menor probabilidad de contaminación por DNA materno.
Sin embargo la utilización de esta técnica se halla restringida a aquellos
centros hospitalarios que dispongan de personal adecuadamente cualificado para
su realización.
Las técnicas de diagnóstico molecular utilizadas incluyen tanto el diagnóstico
indirecto mediante estudios de análisis de ligamiento de marcadores intra o
extragénicos como las técnicas de diagnóstico directo. Entre estas últimas la
técnica de elección es la secuenciación nucleotídica directa dado que obvia los
problemas asociados a las técnicas indirectas, tales como la probabilidad de
recombinación y la falta de informatividad de los marcadores polimórficos.